Conditions Générales de Vente | Mentions légales | Politique de confidentialité | Fait avec ❤️ en France © 2021-24 Elise Poirier – Tous droits réservés.
Le microbiote intestinal
Ami ou ennemi ?
Le best-seller de Giulia ENDERS « Le Charme Discret de l’Intestin », parut en 2014 (1), a révélé au grand public l’existence du microbiote intestinal (anciennement appelé flore intestinale). Ce mot est entré dans notre vocabulaire quotidien mais sommes nous bien au clair avec sa signification ?
Je vous propose de revenir aux bases en définissant ce qu’est un microbiote, avant de me concentrer sur la flore intestinale en particulier. Nous verrons ensuite comment il se forme, quelle est son utilité. Enfin, nous traiterons des pathologies associées à un déséquilibre et un rapide état des lieux des études scientifiques. Pour finir, nous verrons comment en prendre soin.
Microbiote, étymologie et définition

Le terme microbiote vient du grec mikros pour « petit » et bíotos qui signifie « vie » et fait référence à la somme de la faune et la flore présente dans une région donnée.
Un microbiote est un ensemble de micro-organismes (bactéries, virus, parasites et champignons non pathogènes) qui vivent dans un environnement spécifique (2).
Dans l’organisme, il existe différents microbiotes humains selon l’environnement dans lequel ils se trouvent (peau, sphère ORL, voies respiratoires, tube digestif et organes génitaux). Certains font l’objet de récentes études scientifiques. Les chercheurs reconnaissent l‘existence d’échanges directs et indirects entre les différents microbiotes. Ils réfléchissent d’ores et déjà à de nouvelles potentialités thérapeutiques (3).
Le microbiote intestinal en particulier
Le microbiote intestinal est le plus peuplé d’entre eux. Il abrite 1012 à 1014 micro-organismes, ce qui correspond à un poids de 1,5 kilogramme environ chez l’adulte. Il est localisé principalement dans l’intestin grêle et le côlon, l’acidité gastrique n’étant pas favorable à la présence de la plupart des micro-organismes.
Un écosystème fragile et complexe
L’équilibre de ces écosystèmes est très fragile. Il peut être altéré par la prise d’antibiotiques, par un bain de bouche antibactérien, par des savons… Ainsi, la destruction de bactéries du microbiote peut favoriser la prolifération de la levure Candida, responsable de mycoses par exemple.
On sait aujourd’hui que ces écosystèmes sont en interrelation, la santé de l’un influençant la santé de l’autre, d’où l’intérêt de la prise de probiotiques pour résoudre des problématiques vaginales ou respiratoires par exemple.
Comment se forme-t-il ?
A partir de la naissance
Lors d’une naissance naturelle, par voie basse, le bébé se trouve en contact étroit avec la flore vaginale et fécale de sa mère. Il est alors colonisé par cette dernière qui constituera son premier microbiote digestif. Cette colonisation s’effectue par étapes : d’abord les bactéries intestinales consommant de l’oxygène (dites aérobies) puis, une fois l’oxygène de l’intestin consommé les bactéries (anaérobies) qui ne se développent qu’en l’absence de se gaz prolifèrent.
Les accouchements par césarienne, de plus en plus fréquents dans les pays occidentaux, priveraient le nourrisson de sa principale source de micro-organismes. Une récente étude, publiée dans Nature Medicine en février 2016 (4), a montré qu’il était possible de pallier à ce manque de colonisation bactérienne en mettant le nouveau-né au contact de la flore de sa mère par l’intermédiaire de tissus imprégnés de celle-ci.
Maturation
Le microbiote intestinal primitif s’enrichi au contact des microbiotes cutanés des différentes personnes impliqués dans les soins du nouveau-né. Il va se développer pendant les deux premières années de vie en fonction de l’alimentation et des micro-organismes en présence sur les objets portés en bouche. A noter que le lait maternel favorise un plus large éventail de bactéries comparé au lait maternisé.
Il est généralement considéré que notre microbiote est fixé à l’âge de 2-3 ans avec entre 500 et 2000 espèces de bactéries différentes.
Chacun son microbiote
A l’instar de l’empreinte digitale, la flore intestinale est propre à chaque individu (5). Les scientifiques séparent ainsi les individus en trois catégories suivant la composition du microbiote intestinal. Ces dernières portent le nom d’ « entérotypes » (6).
Des chercheurs du Weizmann Institute of Science ont recalculé le nombre de bactéries intestinales comparé à celui des cellules humaines. Leurs résultats, publiés dans Cell (7), donnent un ratio proche de une bactérie pour une cellule (1:1). Autrement dit, notre corps contiendrait environ autant de bactéries que de cellules humaines. De quoi s’interroger sur notre propre nature…
Les avancées de la science nous permettent dorénavant de séquencer le génome bactérien d’un individu (5). Ce faisant, il devient possible de développer des traitements personnalisés (8), dans lesquels l’apport de prébiotiques, probiotiques, symbiotiques ou postbiotiques serait adapté aux spécificités de l’individu.
A quoi sert-il d'être colonisé par des micro-organismes ?
Des avantages certains
Si nous sommes aujourd’hui constitués pour moitié par des bactéries et pour moitié par des cellules (7), c’est qu’il y a eu, à un moment de notre histoire, un avantage à laisser s’installer au cœur de nos muqueuses ces bactéries et autres micro-organismes.
Nous pouvons nous considérer comme un écosystème à part entière. Les bactéries et levures profitent du gîte (bien installées dans nos muqueuses) et du couvert (principalement grâce aux fibres alimentaires appelées aussi prébiotiques). En échange, elles fabriquent pour nous des vitamines (K, B), trois acides aminés essentiels (valine, leucine, isoleucine), favorisent l’assimilation des nutriments, la digestion de l’amidon, entraînent le péristaltisme… Nous faisant économiser au passage 20 à 30% d’énergie ! (7)
Outre ces avantages métaboliques et digestifs indéniables, la flore intestinale a un rôle de protection de son hôte en participant à la fonction barrière de l’intestin, en empêchant la colonisation par des espèces pathogènes. Le microbiote intestinal participe aussi à la maturation du système immunitaire de l’individu.
Des inconvénients également
Plusieurs études ont prouvé que le microbiote intestinal avait une influence sur le fonctionnement du cerveau. Des chercheurs de l’Institut Pasteur, de l’Inserm et du CNRS ont conduit une étude qui montre qu’un déséquilibre de la communauté bactérienne intestinale peut provoquer un effondrement de certains métabolites qui est responsable de l’état dépressif (9). Ils ont ainsi été en mesure de prouver sur un modèle animal qu’un changement de microbiote pouvait induire un changement de comportement (agressivité/ apathie, anorexie/boulimie…). De plus, il a été démontré qu’un dérèglement du microbiote intestinal serait un facteur de risque de schizophrénie, d’anxiété et de troubles bipolaires.
Symbiose : L’art de vivre en harmonie avec nos bactéries
Tout est question d’équilibre ! Cet équilibre doit être fin et individuel entre un hôte et sa population bactérienne. Il est alors appelée symbiose. Lorsque l’équilibre est rompu, on parle de dysbiose soit une altération qualitative et/ou fonctionnelle du microbiote intestinal.
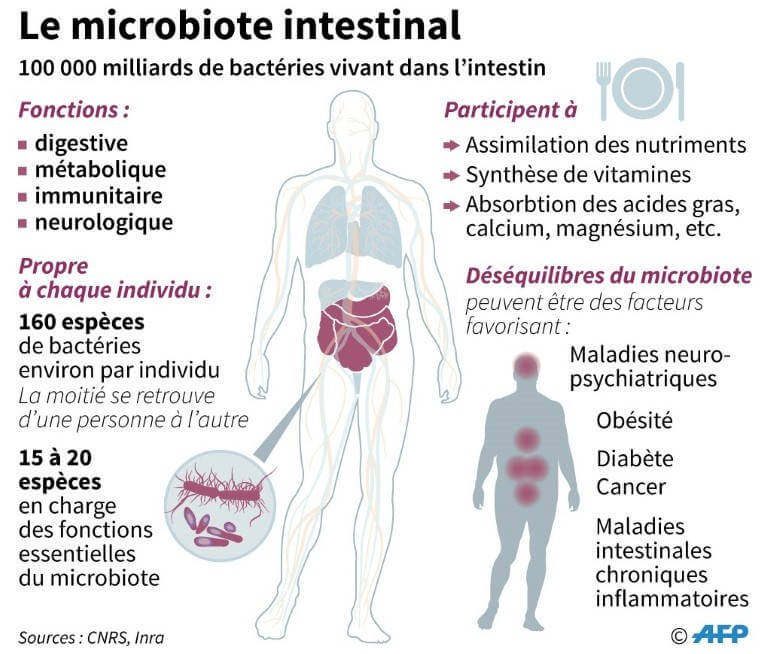
L’étude du microbiote intestinal est devenue centrale pour la recherche médicale. La science a démontré le rôle de la flore intestinale dans les fonctions digestives, métaboliques, immunitaires et neurologiques. Les études cherchent à présent à déterminer le sens des liens entre dysbiose et maladie (7).
Rupture d'équilibre, dysbiose et ses conséquences
De nombreuses études révèlent qu’un déséquilibre du microbiote, plus communément appelé dysbiose, peut être à l’origine de certaines maladies inflammatoires et auto-immunes (maladies inflammatoires chroniques de l’intestin ou MICI, syndrome de l’intestin irritable ou SII) mais aussi de certaines maladies neurodégénératives (Alzheimer, Parkinson, Sclérose en Plaque), de maladies métaboliques (diabète de type 1, obésité…), d’allergies, de cancer, de dépression, de l’autisme…

En plus d’être impliqué dans l’étude des causes de nombreuses maladies et conditions humaines, le microbiote intestinal représente un nouvel élément sur lequel le corps médical pourrait être capable d’intervenir avec des visées curatives. Plusieurs études ont mis en lumière l’association entre certains changements au microbiote et de conditions cliniques particulières, dont :
- l’obésité ;
- le diabète de type 1 ;
- l’inflammation ;
- la sclérose en plaques ;
- la maladie Parkinson ;
- la dépression ;
- les troubles du spectre autistique ;
- certaines maladies métaboliques ;
- plusieurs maladies inflammatoires et auto-immunitaires.
Probiotiques et bactériothérapie, deux pistes thérapeutiques à l'étude
Les études sur les probiotiques sont légions et démontrent des applications dans des domaines très variés. Les laboratoires recherchant les meilleurs combinaisons de microorganismes et la durée de traitement optimale selon la pathologie et la population à traiter.
Les recherches sur les transplantations fécales également appelées bactériothérapies se sont révélées prometteuses dans le traitement de maladies qui ne sont pas directement liées à l’intestin, telles que l’obésité.
Un équilibre fragile à préserver
Si la recherche a démontré la possibilité d’une identité bactérienne individuelle, il n’en demeure pas moins que pour un individu donné, sa population bactérienne est sujette à fluctuation (quantitativement et qualitativement) en fonction de différents facteurs :
- Le moment de la journée et en particulier avant ou après exonération. Des chercheurs canadiens ont ainsi démontré que le nombre de bactéries corporelles est diminué d’un tiers après exonération (7).
- L’hygiène corporelle, par une communication entre le microbiote cutané et intestinal a une influence sur notre population bactérienne intestinale.
- Le stress chronique.
- La consommation excessive d’alcool.
- Les changements de régime alimentaire modifient les proportions des diverses populations microbiennes en fonction des aliments favorisés. Le sucre naturel ou industriel, la farine de blé et tous les aliments transformés favorisent la prolifération des levures et bactéries dans l’intestin. Une alimentation riche en végétaux, si possible crus (parce qu’ils possèdent des antifongiques, excellents gardiens de notre microbiote) va au contraire, combattre la présence de levures dans l’intestin. Les yaourts et aliments issus de la lactofermentation (kéfir, kombucha, choucroute) contiennent beaucoup de probiotiques naturels, qui favorisent l’équilibre du microbiote.
- La présence de pesticides, d’édulcorants et d’additifs dans notre alimentation quotidienne aurait un impact probable sur la composition et de la fonction du microbiote.
- Nous savons aujourd’hui que la prise d’antibiotiques réduit la qualité et la quantité du microbiote sur plusieurs jours à plusieurs semaines (7).
- La fluctuation des hormones sexuelles (testostérone et œstrogène). En effet, le cycle hormonal féminin entraîne de grandes variations du microbiote avec une diminution des lactobacilles et des bifidobactéries juste avant les règles, c’est la raison pour laquelle les femmes ont davantage de troubles digestifs, maux de tête et migraines en période prémenstruelle.
- Certains évènements comme des maladies, un déménagement (changement d’environnement), un changement de partenaire…
Quelques signes de déséquilibre du microbiote intestinal
Parmi les signes de dysbiose intestinale se trouvent notamment :
- la mauvaise haleine,
- la langue chargée (dépôt blanchâtre),
- les troubles digestifs (ballonnements, diarrhée, constipation, reflux)
- et la fatigue.
- Chez la femme, la dysbiose peut également se manifester par des pertes blanches et des mycoses gynécologiques. En effet, il a été observé que les probiotiques que l’on prend par voie orale se retrouvent dans l’appareil gynécologique de la femme 24 à 48h plus tard. Ainsi, en cas de dysbiose vaginale, il est nécessaire de traiter aussi l’intestin pour rétablir une flore gynécologique normale (14).
Anti-Pré-Pro-Post-biotiques, quelle différence ?
- Les Antibiotiques sont des médicaments qui ont la propriété de tuer ou limiter la propagation des bactéries dont ils sont spécifiques.
- Les Pré-biotiques correspondent aux des fibres alimentaires. Ces fibres sont formées par l’association de glucides (sucres) complexes naturels. Ces molécules ont la particularité de résister au suc gastrique et de ne pas être digérées par les enzymes intestinales. Elles ne peuvent donc pas être digérées et absorbées par l’organisme humain. Fermentées par les bactéries du côlon, elles constituent la nourriture favorite du microbiote intestinal.
- Les Probiotiques sont des micro-organismes vivants (bactéries, levures…) présents dans les produits alimentaires fermentés comme le yaourt, la choucroute, le kombucha, la soupe miso ou encore le kimchi. Ils constituent une partie indispensable de la flore microbienne digestive et ont besoin, pour leur survie dans l’intestin, d’un apport d’aliments prébiotiques.
- Les Post-biotiques correspondent à des composés issus de la digestion des fibres alimentaires par les bactéries intestinales. Il s’agit par exemple des acides gras à chaîne courte (AGCC). Les post-biotiques permettent notamment de récupérer de l’énergie à partir des fibres alimentaires non digérées par l’intestin grêle.
- Les Symbiotiques sont formés par l’association de prébiotiques et de probiotiques dans le même repas par exemple en associant un yahourt avec des fruits secs et des graines par exemples. Ils participent à créer une symbiose.
Et l'alimentation dans tout ça ?
S’il peut être intéressant de se complémenter en pré-, pro- ou post-biotiques selon les cas, retenez que l’alimentation joue un rôle primordial dans la qualité de notre microbiote ! Ainsi, une consommation de 30g de fibres par jour permet à l’organisme de produire des AGCC en quantité suffisante pour assurer le bon équilibre du microbiote intestinal. Ces fibres nourrissent favorablement les bactéries et leur permettent de pouvoir produire des AGCC (15). Ces derniers, notamment le butyrate, ont un rôle essentiel dans la prévention des dysbioses intestinales, de l’inflammation des muqueuses, de l’hyperperméabilité et des déséquilibres immunitaires.


Conclusion : une importance capitale pour notre santé
Notre intestin est l’hôte d’un écosystème bactérien. Comme tout écosystème, il est régit par un équilibre fragile et unique en son genre. Ce petit peuple bactérien peut être :
-
un allié précieux de notre santé aussi bien physique que mentale si nous collaborons ;
-
ou bien devenir un ennemi pourvoyeur de pathologies diverses si nous le négligeons, le malmenons.
Ami ou ennemi, c’est à nous de choisir ! Il revient à chacun d’entre nous de préserver le fragile équilibre de sa population bactérienne par une hygiène raisonnée, des aliments appropriés et diversifiés, une eau de qualité, une médication adaptée…
Articles suggérés :
Références
- Enders, G (2014) Le charme discret de l’intestin, éd. Actes Sud. 384 pages. 13€.
- Site de l’INSERM. Dossier sur le microbiote intestinal. https://www.inserm.fr/dossier/microbiote-intestinal-flore-intestinale/
- Site de la Société Française de Microbiologie. https://www.sfm-microbiologie.org/2020/06/10/9870/. Consulté le 19/03/2022.
- Khoruts, A. First microbial encounters. Nat Med 22, 231–232 (2016). https://doi.org/10.1038/nm.4042. Consulté le 17/02/22.
- Eric A. Franzosa. Identifying personal microbiomes using metagenomic codes. PNAS. Consulté le 17/02/22.
- Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR et al. Enterotypes of the human gut microbiome. Nature. 2011 473(7346):174-80.
- Ron Sender & al. Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans. Cell. Consulté le 10/02/22.
- Site de la Société Française de Microbiologie. https://www.sfm-microbiologie.org/2020/10/28/modulation-du-microbiote-intestinal-vers-une-medecine-personnalisee/
- Chevalier, G., Siopi, E., Guenin-Macé, L. et al. Effect of gut microbiota on depressive-like behaviors in mice is mediated by the endocannabinoid system. Nat Commun 11, 6363 (2020). https://doi.org/10.1038/s41467-020-19931-2
- Site de l’INSERM. Dossier sur les maladies auto-immunes. https://www.inserm.fr/dossier/maladies-auto-immunes/
- Site de l’INSERM. Communiqué du 11 déc. 2020. https://presse.inserm.fr/le-microbiote-intestinal-participe-au-fonctionnement-du-cerveau-et-a-la-regulation-des-humeurs/41755/
- Site de l’INSERM. Actualité.https://www.inserm.fr/actualite/anorexie-boulimie-proteine-bacterienne-mise-en-cause/
- Faculté de Medecine. Université de Montréal. https://nouvelles.umontreal.ca/article/2019/07/17/la-maladie-de-parkinson-pourrait-elle-etre-declenchee-par-une-infection-intestinale/. Consulté le 18/02/22.
- Vujic G, Jajac Knez A, Despot Stefanovic V, Kuzmic Vrbanovic V. Efficacy of orally applied probiotic capsules for bacterial vaginosis and other vaginal infections: a double-blind, randomized, placebo-controlled study. Eur J Obstet Gynecol Reprod Biol. 2013 May;168(1):75-9. doi: 10.1016/j.ejogrb.2012.12.031. Epub 2013 Feb 7. PMID: 23395559. Consulté le 18/02/22.
- Estruch R, Ros E, Salas-Salvadó J, Covas MI, Corella D, Arós F et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N Engl J Med 2018; 378:e34. Consulté le 21/03/2022.


